これまでに日本語の雑誌に掲載頂いた雑文やインタビュー頂いた記事(一部)を転載します(許諾済)。
有難う!アベマキの大樹 | An Interview with Professor Mitinori Saitou | 生命の根幹を支える生殖細胞の発生のメカニズムを解き明かしたい。 |思い出の論文 | 電顕に期待すること |1枚の写真館 |
有難う!アベマキの大樹
出典:京都大学医学研究科リレーエッセイ 2024年8月29日
今年の夏も暑い。私は暑い夏が好きだった。多くの男子がそうであるように、私も、子供の頃、虫採りや魚採りが大好きで、夏はその季節だからだ。私は、兵庫県尼崎市で生まれ育ったが、私が小学生だった1970年代終わり・1980年代初め当時は、まだ周りに田んぼや原っぱ、小さな森が残り、そうした場所でよく遊んだ。だが、すぐ近くにはカブトムシやクワガタの採れる場所はなかった。そんな中、父が、川西の奥にある多田銀山でカブトムシやクワガタがよく採れることを聞きつけ、毎夏、家族で銀山に虫採りに行くのがとても楽しみであった。銀山入り口の旧代官所で頂いた冷たい麦茶が美味しかった。
そんな私も、中学・高校・大学と進学するにつれ、これも多くがそうであるように、勉学やクラブ活動、将来の方向性に考えを巡らせることにほとんどの時間を割くようになり、子供の頃の遊びに思いを馳せることは無くなった。京都大学医学部時代の様々な経験から、私は研究者となることを志し、医学部卒業後すぐに大学院に進学、その後イギリス・ケンブリッジに留学し、2003年の春に、運良く、神戸に新設された理化学研究所 発生・再生科学総合研究センター(理研CDB)のポストを得た。この頃長男が生まれ、また、5年後には長女に恵まれた。
神戸時代は、CDBの優れた環境のもと研究に集中し、また、小さかった子供達と楽しい時間を過ごした。長男が3, 4歳になると、忘れかけていた子供の頃の遊びを思い出す。幸い、近くに住吉川という清流が流れ、暑くなると、日曜の度に長男を連れて住吉川に行き、カワムツやアブラハヤ、藻屑ガニを捕まえた。こうなると、次はカブトムシ!、となる。そこで父に連れられた多田銀山を思い出した。神戸からは、六甲山トンネルを通り三田を越えて1時間程の行程となる。日の出前、昔の記憶を辿り、確かこの樹だったよな、とカブトムシやミヤマクワガタを長男と探すのは楽しく、毎夏のイベントとなった。CDBには、京大理学部動物学教室出身で進化形態学を専門とする倉谷滋さんがおられ、その所蔵する日本や世界の昆虫採集標本には圧倒された。
2009年に母校に着任することとなり、家族で修学院の妻の実家に上がりこませて頂くこととなった。比叡山麓の修学院は、東に少し登ると曼殊院や詩仙堂がある、自然・文化ともに豊かな場所だ。ちょうどこの頃、CDB所長の竹市雅俊先生から、 “MUSHI”というタイトルのメールがあり、「なんだこれは ??」、と開いたところ、「今度研究室メンバーで虫採りに行くので、斎藤さんがカブトムシを採りに行く銀山の樹を教えてほしい。」とのこと。竹市さんと言えば、京大理学部時代、教授の岡田節人先生と大原で珍しいカミキリムシを探しているうちに、ついうっかり教室のミーティングを忘れてしまう程の昆虫好き、と伺っていたので(記憶違いなら申し訳ございません!!)、これは重要な要件だ、と思い、樹の位置を示す図をできる限り正確に描いて、すぐに返信した。後程お会いした際に、「すぐにわかったよ。有難う。」と言われ、良かった!と思ったのを思い出す。
そんな中、ある夏の夕方、小学生になった長男と、「近くに良い樹はないかなあ」、と曼殊院あたりを散策した。曼殊院入り口横の武田薬品京都薬用植物園正門に来ると、門衛さんが、「昨日ここの水銀ランプに飛んできたカブトムシ捕まえといたんで、あげますわ」と言われ、カブトムシを頂いた。お話しすると、「ちょっと上がったところにあるアベマキの樹に昔はいっぱいカブトムシがついとった。近頃はずいぶん減ったかなあ」とのこと。これは早速探してみよう!と、まずは昼間にその樹を探した。曼殊院すぐ手前のお堂裏手の池の周りを歩くと、鬱蒼と茂った、樹液をタラタラと流す大木があり、コクワガタやスズメバチが群がっている (図1)。この樹がそのアベマキの樹に違いない、と夜に再び長男と出かけてみると、首尾よく樹液に集まるカブトムシを見つけることが出来た。
以来、この樹にはよく通った。夏の夜、仕事帰りに気が向くと、「今からちょっとカブト探しに行く ?」と息子や娘を誘い、1時間程アベマキの周りをうろうろとし、虫に刺されながらも、カブトムシやノコギリクワガタを捕まえて楽しんだ。教室のメンバーも、お子さんが年頃になると、この樹にカブトムシを探しに行くようになった。皮膚科の椛島健治さんと夜に待ち合わせて一緒に見に行ったこともある。娘が小6となり、夏休みの自由課題に悩んでいたので、「パパが7月8月と毎晩同じ時刻にアベマキの樹に通ってカブトムシが何匹いるか記録するから、それまとめて課題にしたら ?」と提案し、勝手に毎晩アベマキの樹に通って、見つけたカブトムシを全て携帯写真で撮ったりもした(結局娘には課題として採用されなかったが、、、) (図2-7, 動画1)。こうして曼殊院のアベマキの樹は私の大事な場所となった。
その翌年のことである。教室の秘書さんが、「先生、昨日うちの旦那がアベマキの樹に行ったんですけど、樹液が出ていなくて、ムシもいませんでした。」という。「え、そんなことはないでしょう。」と言いつつも、信頼する秘書さんの話だ。私も見に行くことにした。すると、確かに樹液が出ておらず、昼間あんなに簡単に見られたコクワガタさえいない。よく見ると、樹の幹に、どう見ても人工の、樹幹の中心に届く程の穴が数ヶ所開けられている。理由はわからないが、人工的に枯死させられたのか、、、。
何故かはわからない。理由はあるのだろう。ただただ私はショックを受け、焦り、とても悲しくなった。樹の周りを何度も周ったがどこからも樹液は出ておらず、ムシも見当たらない。暫くして、わけのわからぬまま諦念し、樹の周りを去り、遠くから眺めてみた。すると、周りの樹々は夏の緑で深く覆われているにも関わらず、一際高く聳えるそのアベマキの大樹のみが枯れ、枝の先まで全く葉がついていないことがわかった。私は、未だ実感の湧かぬまま、ただとても悲しい気持ちで、これまで有難うございました、、、とアベマキの樹にお辞儀をした。自然に涙が溢れたのを覚えている。
その後何度かアベマキの樹を訪ねたが、同じ状態のまま立っている。本当に残念ではあるのだが、樹がまだ残っているのは嬉しい。教室の秘書さんも、「先生、うちの旦那が吉田山にカブトムシが沢山いると聞きつけました。」とのこと。実際、京大真近の吉田山山頂ではクヌギやナラなどの落葉広葉樹が保全されているようである。また、准教授の大田さんが曼殊院近くでカブトムシが集まる別の樹を見つけられた。曼殊院のアベマキの大樹にはもうムシは集まらないが、京都大学は変わらず自然に恵まれた環境の中にある。こうした環境の中で医学・生命科学の研究に関われるのは素晴らしいことだ。一方で、今年を含め最近の夏の暑さが異常なのは間違いない。自身を取り巻く世界を変化させ続けるヒトの活動はどこに辿り着くのか、そうしたヒトの形質はこの先どう「進化」しうるのか、これからの医学・生命科学の最も重要なテーマの一つではないか。

私が最初に訪ねた際は、左に伸びる、幹とよべる太い枝が残っていた。


(2019年8月)。




動画1: アベマキの樹で交尾をするカブトムシ (2019年8月)。
An Interview with Professor Mitinori Saitou
出典:Biology of Reproduction, 2018, 98(2), 150-152 (doi: 10.1093/biolre/iox171).
Mitinori Saitou is a Professor at the Department of Anatomy and Cell Biology, Graduate School of Medicine, Kyoto University. His research over the last two decades focused on understanding the mechanisms that regulate specification, proliferation, development, and function of germ cells in vitro. His laboratory was the first to succeed in reconstituting the mouse germ-cell specification pathway in culture and to generate functional male and female gametes from embryonic stem cells and somatic cells reprogrammed to pluripotent stem cells (iPSC) [1, 2]. He has since expanded on these groundbreaking achievements by improving technology, expanding to species other than mice, and providing new clues regarding germ cell development. We asked him to reflect about his career progress and current challenges, future goals, and significance of research in germ cell field.
1. When did you first become interested in germ cells and what made you want to become a scientist to study them?
When I was a graduate student (1995-1999), I was working on the structure and the function of one of key cell-to-cell junctions, tight junctions (TJs), in the laboratory of Prof. Shoichiro Tsukita at Graduate School of Medicine, Kyoto University. Prof. Tsukita was a prominent cell biologist, who was most famous for his work on the identification of the integral membrane proteins constituting TJs (Occludin, Claudin family, and Tricellurin) [3]. During his under/graduate studenthoods, he had looked at many cell types and subcellular structures throughout the body using various techniques involving electron microscopy and has acquired extensive knowledge on all the cells constituting our body. He cultivated a strong philosophy that “a beautiful structure is associated with important functions.” Based on this idea, he established a method for biochemically purifying a fraction enriched in cell-to-cell junctions from rat bile canaliculi [4] and succeeded in isolating many key molecules constituting cell-to-cell junctions, including integral membrane proteins of TJs [3].
I was very much fascinated by his work and strategy, and joined his laboratory after graduating with a medical degree from Faculty of Medicine, Kyoto University. While working on TJs, I searched for an “unexplored structure” that is beautiful and may have key cellular functions, and which I could explore during my future career. When I was reading a textbook of developmental biology, I came up with a structure called “germ plasm”, which, when inherited upon embryonic cleavage divisions in organisms such as flies and frogs, appears to instruct the inherited cells to become germ cells. I found this structure and concept very interesting, and thought that if I can biochemically isolate “germ plasm” and determine its molecular components, such work may uncover the mechanism on why only germ cells can eventually become “totipotent” and transmit genetic information. However, subsequently, I noted that germ cells or eggs in mammals lack the “germ plasm”, and mammalian germ cells are induced into pluripotent cells perhaps by a signaling mechanism [5]. Furthermore, I learned the concept of genome imprinting and its erasure and addition during mammalian germline development [6, 7], which, I think, is the origin of the concept of “epigenetic reprogramming” in the germ line. I also noted that the structure often referred to as “nuage”, which is somewhat similar to the “germ plasm”, emerges in mammalian germ cells colonized in embryonic gonads [8]. I felt that all these observations were very interesting, and importantly, very little was known regarding the mechanism responsible for mammalian germ cell development at that time. I realized that the work on “germ plasm” itself would progress through genetics using organisms such as flies and worms, and because I studied medicine and was interested in mammals, I decided to work on mammalian germ cell development, with the initial focus on the mechanism for the specification of mouse primordial germ cells (PGCs).
2. You made many important contributions to the germ cells field. Which of them do you consider the most important and why?
It is not really easy to pick up just one, because our work has been progressing in a step-by-step manner so that a new project/work has always been based on the findings of a previous project/work. But if I must pick up one, I would select the work by Yasuhide Ohinata et al. when we were at RIKEN CDB (2003-2009) [9]. In this work we clarified a principle on how germ cell fate in mice is induced in epiblast cells by signaling molecules coming from extra-embryonic tissues and demonstrated that essentially all the epiblast cells at around embryonic (E) 6.0 are competent to take on the germ cell fate in response to the key signaling molecule, bone morphogenetic protein 4 (BMP4). At this time, the precise mechanism for germ cell specification was not known, and both one-step and two-step signaling mechanisms were postulated [10, 11]. Our work unambiguously demonstrated that one signaling molecule (BMP4) in competent epiblast cells is sufficient for inducing the germ cell fate and the epiblast cells bear such competence from E5.25 to E6.25 [9]. Remarkably, in this work, we also demonstrated that the PGC-like cells induced from the epiblast ex vivo contribute to spermatogenesis when transplanted into testes of neonatal mice lacking endogenous germ cells [9], serving as the foundation for subsequent strategies inducing the germ cell fate from pluripotent stem cells in vitro [1, 2].
3. What was the most exciting moment in your research career to date?
There were many exciting moments, which are also difficult to compare to each other. I started my work on mouse PGCs with Prof. Azim Surani at the Gurdon Institute in Cambridge, with the aim of identifying key genes for PGC specification (1999-2003). At that time, there were no genes known to be expressed specifically in PGCs upon their specification. As PGCs are few in number (~40 cells) upon their specification, I decided to take on the strategy for differential screening of single-cell cDNAs generated from PGCs and their neighbouring somatic cells. I cut out a small fragment of an embryo expected to contain PGCs, dissociated it into single cells, picked up single cells randomly, and generated many single-cell cDNAs. However, it turned out to be very difficult to tell which cDNAs were generated from PGCs, as there were no specific markers. I checked expression of many markers including Oct4 (Pou5f1), Tnap (Alpl), T, and Bmp4, but their expression among many single-cell cDNAs did not give a consistent pattern leading to a potential identification of PGC cDNAs. When I discussed this result with Azim, he remembered a seminar given by Dr. Kirstie Lawson, who made pioneering contributions to the origin of mouse germ cell lineage by clonal analysis [5]. Azim said to me that Kirstie told that some gene was specifically “repressed” in PGCs but expressed in neighboring somatic cells, but he forgot the gene name. So, after this discussion, Azim asked Kirstie about the gene and she very kindly let us know that it is Hoxb1. I immediately examined the expression of Hoxb1 in my single-cell cDNAs and found that the single-cell cDNAs are clearly divided into two types, one positive for Hoxb1 and the other negative for Hoxb1, and the Hoxb1-negative cells tend to have higher Tnap expression. I was very excited with this result and convinced that the Hoxb1-negative cDNAs are derived from PGCs [12]. The genes specific to/highly expressed in PGCs including Ifitm3 (fragilis), Dppa3 (Stella/Pgc7), Prdm1 (Blimp1), and Prdm14 were identified from these cDNAs [12-14].
In RIKEN CDB, we improved the single-cell cDNA amplification method, with Kazuki Kurimoto and Yukihiro Yabuta, in terms of representative and quantitative amplification of original mRNAs so that it can be applied to microarray analysis [15]. It was a stunning experience when we first looked at the heatmap of genes differentially expressed by PGCs and by their neighboring somatic cells, where all the genes that I identified by classic differential screening were included and so many more genes defining the properties of PGCs [16]. Our method has subsequently been adapted to single-cell RNA sequence [17], which is so prevalent in current life sciences.
We moved to Kyoto University in 2009 and initiated the work on in vitro gametogenesis with Katsuhiko Hayashi and Hiroshi Ohta. The moment when I first looked at the spermatozoa derived from PGC-like cells (PGCLCs) induced from embryonic stem cells (ESCs) in a microscopy room of my laboratory, with Katsuhiko and Hiroshi, in Spring 2010, was also so impressive that I cannot forget it, and I remember that we commented that this should be the beginning of the in vitro gametogenesis [2].
4. Do you have any role models that inspired you during your career development and/or inspire you now?
As I said earlier, I truly respect the science of Prof. Shoichiro Tsukita in its philosophy and quality, as well as in quantity [3]. I also highly respect Prof. Azim Surani for his long-term passion for germ cell biology and many seminal contributions to the field.
5. What, in your opinion, are the biggest challenges of the reproductive biology field, and germ cell field in particular, and how do you envision overcoming them?
In my opinion, the biggest challenge in the reproductive biology field may be to realize the in vitro reconstitution of the entire developmental period from zygotes to term in mammals. In the germ cell field in particular, in vitro reconstitution of the entire oogenesis and spermatogenesis in as many animals (in particular mammals) as possible should be the biggest challenge. I am personally interested in the differences in the mutation rates between germ cells and various somatic lineages, and feel it will be important to uncover the mechanism for their regulations. I am also very much interested in the time differences required for the development of germ cells among different species, e.g. between mice and humans, and it will be fascinating to explore this aspect using in vitro reconstitution systems.
6. If you were to choose a single, most important research goal that you personally would want to achieve, what would it be?
My current personal research goal is an in vitro reconstitution of human oocyte and spermatogonia development.
7. Your group was the first to develop functional male and female gametes from somatic cells using mouse as a model. How close are we to apply this strategy to other species including humans?
As described in responses to questions 5 and 6, I believe that the application of the concept and the strategy that we have shown in mice to other mammals including humans will be a key challenge in the germ cell field in coming years. It has been becoming clear that the properties of pluripotent stem cells that may be used as starting material for in vitro gametogenesis differ significantly among mammals, and the mechanism and the timeframe required for germ cell development are also quite divergent among mammals. Embryonic gonadal somatic cells that are critical/currently essential for in vitro gametogenesis are not readily available in animals other than mice. I therefore think that continuous, careful studies on various aspects of germ cell as well as gonad development in other species, including the development of relevant reproductive technologies such as spermatogonial stem cell propagation and in vitro oocyte growth, are essential to apply the mouse strategy to other species, and such efforts are in their incipient stages [18, 19]. It is, however, always possible that things progress much more rapidly than we currently assume.
8. Gametogenesis in vitro is of great interest and importance to us scientists but manipulations of gametes or embryos often raise public concerns. Could you comment on how you see the importance of germ cell research in regard to these concerns?
Very recently, we have described our ideas on the relevant issues in [19]. Please see this reference.
9. Being so successful requires a lot of work hours, especially in Japan. How do you cope with it? Do you have any interests outside the lab? Do you have a recipe for a balanced life for an accomplished scientist?
I have been very lucky to be able to work with many talented, highly motivated colleagues including those whose names I have given in my earlier responses. It has been a great privilege and so enjoyable to have them as colleagues. Performing experiments and discussing the results with them in the lab have therefore been and continuously are a great fun. I usually take Sundays off and spend time with my family (wife, son, daughter). They are somewhat used to the state that I am at home only early in the morning/late at night and on Sundays, but I just enjoy very much the time I spent with them. I commute to the lab by car, and it is a ~15 min drive. On the way back home, I often listen to my favorite music, playing it in the car very loudly. This is a moment that I can really be relaxed and like very much.
10. What advice do you want to give to next generation of reproductive biologist/germ cell biologists to help them succeed?
I think that the minimum requirements may be to study/work passionately and hard and to become confident in yourself, believing that you have the best knowledge and expertise in what you are working on and in your own field. Additionally, I think it important for you to have broader knowledge and interests in more diverse areas of biology and science in general, which will always help you to evaluate objectively the significance of your own work and to gain insight into the directions of your next investigations.
Monika A Ward
Associate Editor, Biology of Reproduction
Institute for Biogenesis Research, John A. Burns School of Medicine, University of Hawaii
Correspondence: mward@hawaii.edu
References
- Hayashi K, Ogushi S, Kurimoto K, Shimamoto S, Ohta H, Saitou M. Offspring from oocytes derived from in vitro primordial germ cell-like cells in mice. Science 2012; 338:971-975.
- Hayashi K, Ohta H, Kurimoto K, Aramaki S, Saitou M. Reconstitution of the mouse germ cell specification pathway in culture by pluripotent stem cells. Cell 2011; 146:519-532.
- Takeichi M. Shoichiro Tsukita: a life exploring the molecular architecture of the tight junction. J Cell Biol 2006; 172:321-323.
- Tsukita S, Tsukita S. Isolation of cell-to-cell adherens junctions from rat liver. J Cell Biol 1989; 108:31-41.
- Lawson KA, Hage WJ. Clonal analysis of the origin of primordial germ cells in the mouse. Ciba Found Symp 1994; 182:68-84; discussion 84-91.
- Surani MA, Barton SC, Norris ML. Development of reconstituted mouse eggs suggests imprinting of the genome during gametogenesis. Nature 1984; 308:548-550.
- McGrath J, Solter D. Completion of mouse embryogenesis requires both the maternal and paternal genomes. Cell 1984; 37:179-183.
- Eddy EM. Germ plasm and the differentiation of the germ cell line. Int Rev Cytol 1975; 43:229-280.
- Ohinata Y, Ohta H, Shigeta M, Yamanaka K, Wakayama T, Saitou M. A signaling principle for the specification of the germ cell lineage in mice. Cell 2009; 137:571-584.
- Lawson KA, Dunn NR, Roelen BA, Zeinstra LM, Davis AM, Wright CV, Korving JP, Hogan BL. Bmp4 is required for the generation of primordial germ cells in the mouse embryo. Genes Dev 1999; 13:424-436.
- McLaren A. Signaling for germ cells. Genes Dev 1999; 13:373-376.
- Saitou M, Barton SC, Surani MA. A molecular programme for the specification of germ cell fate in mice. Nature 2002; 418:293-300.
- Ohinata Y, Payer B, O'Carroll D, Ancelin K, Ono Y, Sano M, Barton SC, Obukhanych T, Nussenzweig M, Tarakhovsky A, Saitou M, Surani MA. Blimp1 is a critical determinant of the germ cell lineage in mice. Nature 2005; 436:207-213.
- Yamaji M, Seki Y, Kurimoto K, Yabuta Y, Yuasa M, Shigeta M, Yamanaka K, Ohinata Y, Saitou M. Critical function of Prdm14 for the establishment of the germ cell lineage in mice. Nat Genet 2008; 40:1016-1022.
- Kurimoto K, Yabuta Y, Ohinata Y, Ono Y, Uno KD, Yamada RG, Ueda HR, Saitou M. An improved single-cell cDNA amplification method for efficient high-density oligonucleotide microarray analysis. Nucleic Acids Res 2006; 34:e42.
- Kurimoto K, Yabuta Y, Ohinata Y, Shigeta M, Yamanaka K, Saitou M. Complex genome-wide transcription dynamics orchestrated by Blimp1 for the specification of the germ cell lineage in mice. Genes Dev 2008; 22:1617-1635.
- Tang F, Barbacioru C, Wang Y, Nordman E, Lee C, Xu N, Wang X, Bodeau J, Tuch BB, Siddiqui A, Lao K, Surani MA. mRNA-Seq whole transcriptome analysis of a single cell. Nat Methods 2009; 6:377-382.
- Saitou M, Miyauchi H. Gametogenesis from Pluripotent Stem Cells. Cell Stem Cell 2016; 18:721-735.
- Ishii T, Saitou M. Promoting In Vitro Gametogenesis Research with a Social Understanding. Trends Mol Med 2017; 23:985-988.
第16回
生命の根幹を支える生殖細胞の発生のメカニズムを解き明かしたい。
出典:公益財団法人テルモ科学技術振興財団 中高生と "いのちの不思議"を考える 生命科学DOKIDOKI研究室 第16回
掲載サイト: 財団法人テルモ科学技術振興財団 インタビュー一覧
●自然や宇宙に興味を持っていた子ども時代
───子どもの頃はどんな遊びをして過ごしたのですか。
兵庫県の尼崎市で育ちました。当時はまだあちこちに自然が残っていて、カブトムシやクワガタムシなどを捕って遊んでいました。中でも好きだったのは水の中や水辺に生息している昆虫です。たんぼやため池には小魚、沼エビなどのほかにタガメなどの肉食の水生昆虫がいました。タガメは、カマキリのような大きなカマを持っていて、自分より大きなトノサマガエルなどを捕まえて、血を吸うんです。こういうのを見るのが好きでしたねえ(笑)。
ただ、この頃から農薬の影響でタガメなどが激減し、図鑑やテレビでしか見られない時代になってきたのですから、そういう意味ではまだ恵まれた環境で育ったといえるかもしれません。
───科学者になりたいなどとは思わなかったのですか。
よく天文学の本などを読んで宇宙には興味を持っていました。ちょうど赤塚不二夫の「ニャロメのおもしろ宇宙論」という本が出版されて、「宇宙の果てはどうなっているんだろう」なんて考えたものです。宇宙科学だけでなく、「自分って何だろう」とか「死んだらどうなるんだろう」などと、人間の存在についても考えていましたね。なぜか理由はわからないけれど、10歳になったら自分はもう年寄りだと考えていて、「10歳になったら終わりやな、死んだら真っ暗闇だ、おそろしいなあ」なんて思ったものです(笑)。
小学校高学年になると、ちょうど受験戦争が始まった時代で、親戚のお兄ちゃんが塾に通って進学校に入った話を聞きつけた母に、「あんたもやりなさい」といわれて、塾に通って勉強して、ちょうど近くだった、進学校で有名な灘中学に入りました。
中学生になると宇宙物理学などにまた興味を持って、その関係の本を読み漁ったのですが、宇宙についての学問って、人の気配がしないさみしい学問なんだなあって思って(笑)、もう少し人の気配がする学問がいいと考えるようになりました。
───それで、生物学などに興味を持ったわけですか。
ええ、ちょうど東京大学の時実利彦先生の「脳の話」が岩波新書で出ていて、それを読んだら非常におもしろく、神経生物学に興味を持ったんです。カマキリは中枢神経を複数持っていて、頭がなくなっても動く機械のようなものだということが書かれていて、では人間も機械みたいなものなのかと思って衝撃を受けました。
あの頃はよく本を読んでいましたね。森林などの生態学の本やサル学、京都大学の今西錦司や桑原武夫はじめ、山岳部や探検部、人文科学研究所の学者の本とか・・。中間や期末試験が終わると、本屋に飛んで行って、本を買うのが楽しみでした。
───高校時代は勉強一筋だったのですか。
いいえ、灘校は進学校として知られてはいますが、ガリ勉をする高校ではなく、のびのびしていましたよ。バスケット部に入って部活も楽しんでいました。
理系はどの教科も好きでしたが、世界史なんかも好きでしたね。板書はほんのちょっとだけで機関銃みたいにしゃべりまくる先生の話を、全部必死にノートに取って(講義のあとはくたくたでした)、試験前に清書してみんなに配って人気があったんですが、途中でそれをワープロでやる生徒が出てきてそっちのほうが好評で「ワープロ派に負けた!」と悔しがったり(笑)。
───大学選びはいかがでしたか。
高2のときには理系に進もうということは決めていました。でも研究者は、ニュートンとかアインシュタインとかの天才がなるものだと思っていて、自分がなれるというリアリティはまったくなかった。では将来どんな仕事をしようかと考えたときに、自然がどんどん少なくなっていることが悲しくて、農学部や理学部に進んで、国連に入って自然保護活動などをやってみたいと考えたんです。
でも親に相談したら、「そんな役にも立たないことを考えていないで医者にでもなれ」って(笑)。そこで自分のやりたいことをもう一度考えてみると、生物学のほかに、脳や神経にも興味がある。それならば医学部に行けばより深く学べるし、チャレンジングではないか。京都大学も好きだし、京大の医学部に進学しようと決めました。
●生命をつないでいく生殖細胞を研究したい
───大学ではどんな学生生活を送られたのでしょう。
入学したら探検部に入ろうと思っていたんです。ところが、部室の前に行ったら「バカは来るな!」と貼り紙がしてある。こんなことを書く方がアホだと思って、入部するのをやめました(笑)。それで中高校時代にやっていたバスケットボールの延長で、ハンドボール部に入って結構楽しい大学生活を送っていましたね。
バブルの時期です。まわりは将来が医者と決まっているせいか、あまり勉強しませんでしたね。私も大学1 年の終わり頃に、かっこいいバーに友だちと飲みに行って、こんなところでバーテンダーをやってみたいとアルバイトの面接を受けたら、社長に「お前はお笑い系やな」と言われ、系列のカラオケパブに配属になりました。客がステージで歌うときにタンバリンを叩いて盛り上げる役目だったんですが、その店の店員に同志社大学の学生たちがいて、彼らは社会性を持ったしっかりした人たちでした。知識も豊富で、彼らと将来の夢を語り合ったりするうちに、自分もしっかり目標を持って、能力を発揮できる分野を真剣に探さなくてはいけないと思ったわけです。いろいろ考えると、やはり研究者しかない。それでハンドボール部も退部して、本格的に勉強することにしました。
───どんな分野の研究者になろうと思ったのですか。
大学に入った頃から、細胞の増殖や分化にすごく興味がわいて、生命科学関係の本をいろいろ読んでいたんです。フランスの神経生理学者のジャン・ピエール・シャンジューの「ニューロン人間」は、脳の中のモジュール構造とか、中学生のとき読んだ時実先生の本に加えて当時の生命科学の知識を盛り込んでレベルアップした内容で、大いに刺激を受けました。そんなこともあって生命科学系の研究をしたいと思っていたとき、分子生物学の第一人者の本庶佑先生の講義を受けて、すごくおもしろかった。京都大学は分子生物学、生化学分野では間違いなく日本一のレベルだったこともあり、また神経科学に興味はあったものの、神経科学の講義にどうもピンと来なかったので、研究するなら本庶先生の研究室で勉強したいと考え、大学3年生の冬に先生の研究室で手ほどきを受けるようになったんです。最初にご指導頂いたのは当時本庶研の講師であられた仲野徹先生(現大阪大学教授)でした。
それから4年生の夏に海外の研究所に留学できる機会があり、私はニューヨーク大学メディカルセンターで細胞増殖の研究をしようと考えて渡米しました。しかし、そこで3カ月半ばかり一生懸命実験を続けたけれど、全く歯が立たない。ポスドク中心の欧米の研究室の強さを実感しました。もう一度日本で勉強しなおさなければと、日本に帰ってきました。
───日本に帰ってからはどんな研究をされたのですか。
薬理学の実習中に、「ピペットさばきがいい」と誉められて、垣塚彰先生(当時成宮周研究室講師、現京都大学教授)のもとで一つのプロジェクトを任されました。そこで実験のおもしろさや分子生物学の基本的な考え方を身につけることができましたし、論文を2報も書かせて頂きました。当時は生意気盛りで、分子生物学の基本的なことは分かったから少し違うことが出来ないかと考えていたときに、形態学者の月田承一郎先生(故人)のセミナーがあり、それが実に胸躍るおもしろさでした。月田先生は電子顕微鏡で細胞と細胞の間をつなぐ微細な分子構造をじっくり見て、それを分子的に説明する形態学的分子生物学を専門にされていました。
先生の研究はすごくビジュアル的で、まるで、とてもレベルの高い映画でも見るようなサイエンスがあるものだと感動して、大学院では月田研究室に入りました。そこで、形態学的分子生物学を学び、また月田先生や研究室の先輩・同僚とじっくり議論しながら、将来の自分のテーマを考え続け、大学院の3年生頃に、生殖細胞をテーマとしようと決めたのです。
───生殖細胞をテーマにしようと考えたのはなぜですか。
生殖細胞を研究することで、生命の根幹の謎に迫れると感じたからです。精子や卵子を作り出す生殖細胞は、皮膚や心臓、肝臓などの器官や組織を形づくる体細胞とまったく異なる性質を持っています。体細胞は寿命が来ると死んでしまいますが、生殖細胞は生命を次の世代に受け継いでいく役割を持っています。つまり極端な言い方をしますと生殖細胞だけが死なない。生殖細胞の役割は中学生でも知っているのに、そのメカニズムはまだ知られていなかったのです。その謎を突き止めたいと考えたわけです。
●始原生殖細胞形成の鍵を握る遺伝子を発見
───生殖細胞と体細胞の違いをもう少し詳しく説明してください。
私たちのからだは、少なく見積もっても210種類、全部で60兆個もの細胞が集まってできています。これらの細胞は、すべて一つの受精卵から分化・増殖してできていることは知っていますね。これらの細胞群は、受精卵から受け継いだ同じDNA配列を持っています。このDNA配列のことをゲノムといいますが、細胞ごとに働いている遺伝子の組み合わせが違います。
体細胞は、分化の過程でいったん皮膚や心臓、神経などの系統が決まってしまったら、違う系統にはなりません。血液細胞が骨になったりはしないわけです。なぜ細胞の運命が決まってしまうのかというと、それぞれの細胞で使われている遺伝子と、使われていない遺伝子があるからです。最近の研究で、細胞の運命を固定する役割を担う因子が、遺伝子の働きを制御しているからだということがわかってきました。これが今では「エピジェネティック制御」と呼ばれるしくみです。
ところが生殖細胞だけは、精子と卵子が形成される過程や、それらが融合する受精によって、生殖細胞自身の遺伝情報がいったんリセットされて組み直され(ゲノム・リプログラミング)、再び次の個体を形づくるために体のあらゆる細胞へと分化する「全能性」を獲得します。生殖細胞のこのメカニズムを知りたい。そのために、まず生殖細胞の形成の仕組みを解明しようと考えました。
───当時、このテーマの研究は進んでいたのですか?
ハエや線虫では生殖細胞の形成を担う遺伝子はわかっていましたが、哺乳類では手つかずといっていい状態でした。しかし、これこそが生命にとって本質的に重要なメカニズムで、研究のやり甲斐も大きいはずだと、挑戦することに決めたのです。免疫や神経といった医学の本流からはそれるテーマでしたが、必ず医学的に重要となる日が来ると考えました。
───哺乳類の生殖細胞の形成を研究するにあたっては、どんなアプローチで進めたのですか。
卵子にも精子にもなる生殖細胞の元となる細胞を「始原生殖細胞」といいます。マウスの場合、発生初期の受精後6.5日前後に分化し、その後発生しつつある原腸の壁をすり抜けるように移動して生殖巣にたどり着き、精子や卵子になるのです。
まずこの始原生殖細胞がどのように形成されるのかを調べたい。それを研究するために、英国ケンブリッジにあるウェルカムトラスト発生生物学・がん研究所のアジム・スラニー教授のもとに留学しました。スラニー先生は哺乳類のゲノムには、両親のどちらに由来するものかが記憶されている(ゲノムインプリンティング)というノーベル賞級の発見をした先生です。スラニー先生と毎日のように議論をしながら、始原生殖細胞形成の際に働く遺伝子を同定するために、一つ一つの細胞で働く遺伝子群を丹念に比較するという研究を続けました。半分雲をつかむような仕事でしたが、この手法でしか遺伝子を見つけることができないと信じて、挑戦し続けたのです。
───ショウジョウバエや線虫で見つかっていた遺伝子と同じようなものをマウスで探すというやり方は採用しなかったのですか?
そういうアプローチも有効である可能性もありましたが、ショウジョウバエや線虫とマウスの生殖細胞形成機構の違いから、難しいのではと考えていました。
恩師の月田先生が大切にしていた教え通り「構成力のある正攻法」で一つずつデータを積み上げ、粘り強く研究を進めたのです。論理的にスクリーニングを繰り返していくうちに、ついに、始原生殖細胞以外のさまざまな体細胞へと分化する働きをストップする役割を果たすBlimp1という遺伝子を同定しました。
●ES細胞やiPS細胞から作った生殖細胞で、マウスの赤ちゃんが誕生
───それからどんな研究を進めていったのですか。
この遺伝子の発見で、自分の研究が一気に広がる感触を得ました。そんなときに、理化学研究所で若手研究者にも独立した権限を与えてくれる環境がスタートしたことを知り、日本に戻って研究を進めました。
独自に開発した遺伝子解析手法を用いて、Blimp1以外に、始原生殖細胞の形成に欠かせない遺伝子Prdm14を見つけました。こうして始原生殖細胞が形成される過程で起きているさまざまな現象も次々にわかってきました。
研究をさらに進めるためには、始原生殖細胞がつくられたあと、どのように生殖細胞になるか、発生のプロセスを実際に観察してみたいと考えましたが、とくに哺乳類の生殖細胞は、数も少なく、動きも激しい。そこで、京都大学に移ってからは、ES細胞やiPS細胞から試験管の中で始原生殖細胞をつくる研究に取り組んできました。
ES細胞やiPS細胞に細胞分化を促すタンパク質などを加え、将来胚となる原始外胚葉様細胞を誘導することに成功し、この細胞に、これまでに突き止めた始原生殖細胞への分化を誘導する物質を与えて培養したところ、始原生殖細胞を誘導することに成功しました。
2010年の春には、誘導した始原生殖様細胞を、精子を持たないマウスの精巣に戻して精子を得ました。体外授精したところ、正常なマウスの赤ちゃんが生まれたんですよ。
───先生のこの一連の研究はどんな可能性を持っているのですか。
生殖細胞をつくりだすことができれば、まず、不妊や遺伝病の原因解明に役立ちます。また、エピジェネティック制御や、ゲノム・リプログラミングの機構の解明が進めば、細胞の増殖や分化を自由に制御できるようになる可能性があります医学的に重要な細胞を安全に増やす技術開発の基盤になりますし、がんなどさまざまな病気の治療や予防医療に大きく貢献すると見ています。
───今後のテーマは何ですか。
まさに上述したような方向性で研究を続けたいと考えています。また、同じ哺乳類でも、マウスとヒトでは初期胚の発生メカニズムが肝心なところで大きく異なっていますので、ヒトに近い霊長類での研究が必要です。そこで、滋賀医大の研究グループと、カニクイザルを使った共同研究を始める予定です。
───最後に、中高校生にメッセージをいただけますか。
自分の可能性を信じて、自分のしたい仕事に飛び込んでいってほしいと思います。私自身の経験でいうと、今の社会はやりたいと思うことができる環境が整えられていると思います。将来の夢を大切にして思い切って挑戦することです。
サイエンスの分野ではまだまだ未解明な謎、出来そうで出来ないことがたくさんあります。私たちは自然という中に生きていて、人間の活動も自然科学の上に成り立っています。その原理や真理をひとつずつ解いていくのが研究の醍醐味です。
そのためにも、中学・高校生時代は、古文、地理、世界史、物理など、どんな教科でも勉強して幅広い視野を身につけておくといい。私が師事した月田先生は、「広く学ぶことによって、将来自分の目の前を宝物が通り過ぎたとき、これが自分にとって大事だということがわかる」とおっしゃっていました。正にその通りだと思いますね。
思い出の論文
出典:細胞工学 Vol. 30, No. 8, 882-883, 2011
分子生物学の模範:単一細胞解析によるフェロモン受容体の同定
月田研でのジャーナルクラブ(JC)
私は、医学部卒業後、故月田承一郎先生の大学院(京都大学大学院医学研究科 分子細胞情報学)に進学し、形態学的思考に基づく分子生物学を学んでいた。月田研では、毎週火曜日の午前中にJCが行われた。このJCは、単に最新の論文を1報報告するのではなく、ある分野・ある生物学上のコンセプトがどのような経緯で形成されるに至ったかをその始まりからレビューすることを目的としたものであった。月田さん(月田研では研究者同士は‘先生’ではなく‘さん’で呼ぶことがルールとなっていた)曰く、「自分たちも、将来誰かにその始まりからレビューされるような研究を目指さんとなあ。」で、このJCはそうした研究を目指すための訓練であるとのことであった。私は1度目のJCで四肢のパターン形成原理に関するレビューを行った。モルフォゲン勾配仮説からヘッジホッグ遺伝子の同定までの話をかなり頑張ってまとめたつもりであったが、その週は出張でおられなかった月田さんは、帰って来られてから、「テーマが当たり前やなあ。」とおっしゃられた。生物学上のテーマ自体に平凡(当たり前)も非凡もないのでは、と思ったが、次は月田さんが絶対知らないような分野の話をしようと考えた。
匂い物質とフェロモンの受容体の発見
そこでその当時神経科学の分野で騒がれ、少し気になっていた、嗅覚受容機構とその神経回路、のレビューをすることにした。テーマの選び方は月田さん的にはまたも安易だったかもしれないが、勉強してみれば驚く程面白いテーマであった。匂い物質が鼻腔に存在する嗅上皮(双極性の嗅神経細胞が一層に並ぶ)に引き起こす生理学的反応や、嗅神経に始まる嗅覚の神経回路に関しては、古くからの知見があったが、嗅神経に発現する受容体、極めて多様な匂い物質の違いが‘嗅ぎ分けられる’メカニズムに関しては、全くわかっていなかった。1991年にRichard AxelとLinda Buckは、それまでの生理学的知見をもとに、1)匂い受容体はG蛋白質共役7回膜貫通型受容体である、2)多種類の匂い物質を識別するため、匂い受容体は遺伝子ファミリーを構成し多様である、3)匂い物質受容体遺伝子は嗅上皮(嗅神経)に限局して発現する、という3つの仮説をたてた。これら仮説に基づき、彼らは、その当時知られていたG蛋白質共役7回膜貫通型受容体間で相同性の高い領域を認識するディジェネレートプライマーを作成し、‘嗅神経由来のRNAから特異的に増幅される遺伝子産物で、単一に見えるが制限酵素で切断すると多数の産物からなる(遺伝子ファミリーを構成するので)増幅産物’を同定する、という戦略で、見事、〜1000種類にも及ぶ匂い物質受容体遺伝子ファミリーを同定した1。その後の研究で、各嗅神経は〜1000種類の受容体のうち1つだけを高レベル(全mRNAの〜1%)で発現すること、同じ受容体を発現する嗅神経は嗅上皮中にちらばって存在するが、それら由来の軸索は、嗅球の同じ部位に投射することなどがわかり、嗅覚の情報コードの理解は急速に進展することとなった。Richard AxelとLinda Buckはこの仕事により2004年にノーベル医学生理学賞を受賞した。
ところで、鼻腔には、嗅上皮とは別に、鋤鼻器(じょびき、vomeronasal organ: VNO)と呼ばれる神経上皮が存在し、こちらの神経細胞は、匂い情報の中でもより本能的な反応(性行動や攻撃反応など)を惹起する物質(フェロモンと総称される)の情報を伝達することが知られていた。では、鋤鼻器にはどんな受容体が存在するのであろうか?Richard AxelとCatherline Dulacは、この疑問に答えるべく、匂い物質受容体同定時と同様の方法を用いて、フェロモン受容体の同定を試みた。ところが同様のアプローチや匂い物質受容体の遺伝子配列をプローブとしたハイブリダイゼーション法はすべてうまくいかなかった。さらに、鋤鼻器の神経細胞は、嗅神経が発現するG蛋白質やその他の情報伝達物質を発現していないことがわかった。そこで、彼らは発現されている受容体の構造には全く依存しないスクリーニング法を考案した。彼らは、自ら同定・解析を進めていた匂い物質受容体の発現・機能様式をもとに、1)フェロモン受容体は鋤鼻器の神経細胞特異的に発現する、2)各神経細胞は1種類の受容体を高レベルで発現する、という仮説を立て、鋤鼻器の神経細胞1つずつからcDNAライブラリーを作成し、それぞれをディファレンシャルスクリーニングすることにより、単一の神経細胞に特異的に高発現する遺伝子(=それぞれの神経細胞が発現するフェロモン受容体)を同定した。同定した遺伝子の発現及び配列解析から、彼らが同定した遺伝子は、匂い物質受容体とは全く異なる配列の7回膜貫通型タンパク質をコードし、〜40種類からなる遺伝子ファミリーを構成することがわかった2。こうして1995年に、またも見事な論理的分子生物学によりフェロモン受容体が同定されたのであった。これらの論文を読み終えたときは、実験手法・分子生物学的論理の美しさに大いに感動したのを覚えている。
生殖細胞の発生・ゲノム制御機構解明を目指して
これらの仕事をJCでレビューすると、月田さんは、「めちゃくちゃ面白いな、斎藤、勉強しすぎて知恵熱出たんちゃうか」と言われ、私は、これぐらいで知恵熱は出えへんわと思いつつも、なんとなく個人的に満足した。その後、私は、遺伝子発現のエピジェネティックな制御機構に興味を抱き、続く数回のJCで、ゲノムインプリンティング、X染色体不活化、DNAメチル化とメチル化DNA結合タンパク質、ポリコムタンパク質と細胞記憶、などのテーマをレビューし、これらの現象を統合する生殖細胞の発生・ゲノム制御機構に興味を抱くようになった。私は、生殖細胞の発生・ゲノム制御機構が理解出来れば、細胞形質制御機構の本質が理解出来るのではと考え、この解明を大学院修了後の(生涯にわたる)研究テーマとすることに決めた。当時哺乳類の生殖細胞形成機構はほとんどわかっておらず、マウスでは、胚発生7.5日目頃にアルカリフォスファターゼ活性陽性の〜40個程の細胞集団として胚体外中胚葉中に始原生殖細胞が出現する、という事実のみが知られていた3。私は、まず始めに、マウスの始原生殖細胞形成機構の解明を目指すこととし、その第一歩として、‘始原生殖細胞決定因子’を同定することが重要であると考えた。そこで、JCでレビューして以来、いつか自分でもやってみたいと考えていた、Richard AxelとCatherline Dulacの単一細胞発現遺伝子ディファレンシャルスクリーニング法により、〜40個程の始原生殖細胞に特異的に発現する遺伝子群を探索することに決めたのである。1998年のことであった。この研究のその後の展開に関しては、ご興味のある方は他の文献を参照されたい4,5,6。こうして振り返ってみると(振り返るには早すぎるのだが)、大学院時代の研究テーマと全く異なるテーマをその後の研究テーマに選んだわけであるが、その選択と研究の展開法において、月田研でのJCを通して学んだ知識が大きな役割を担ったのは間違いない。生命現象を高い解像度で理解したいと考えるようになったのも、形態学的思考を大学院生時代に学んだ経験に基づくものであろう。研究の更なる発展を目指して奮闘中である。
文献
- Buck, L. & Axel, R. A novel multigene family may encode odorant receptors: a molecular basis for odor recognition. Cell 65, 175-187 (1991).
- Dulac, C. & Axel, R. A novel family of genes encoding putative pheromone receptors in mammals. Cell 83, 195-206 (1995).
- Ginsburg, M., Snow, M. H. & McLaren, A. Primordial germ cells in the mouse embryo during gastrulation. Development 110, 521-528. (1990).
- Saitou, M., Barton, S. C. & Surani, M. A. A molecular programme for the specification of germ cell fate in mice. Nature 418, 293-300 (2002).
- Saitou, M. & Yamaji, M. Germ cell specification in mice: signaling, transcription regulation, and epigenetic consequences. Reproduction 139, 931-942, (2010).
- 斎藤通紀、2008、生まれたての生殖細胞cDNA!、細胞工学、Vol.27、1217.
電顕に期待すること
出典 :細胞工学 Vol. 25, No. 10, 1190-1191, 2006
大学院生時代に超薄切片の作成と観察を少々かじった経験しかない私が‘電顕に期待すること’という表題で一文を書くのは非常に罰当たりな感じがし、また多くの形態学者の先生方に笑われそうなので、 ここでは十数年前に基本的には分子生物学を志した私が多少なりとも形態学を学んだいきさつと、それが現在の研究にどのように反映されているかを述べてみたい。
私が電子顕微鏡写真というものに具体的な興味を持ったのは京都大学医学部5回生の時に、医化学講座の大学院講義に来られた月田承一郎先生の話を聴講した時であった。 その当時基礎医学研究者としての道に挑戦するか臨床医学を目指すのか完全には決断できないでいた私の気持ちは、この講義を聴いた後にほぼ決定的なものとなった。多くの方がご存知のように、 月田先生は東京大学医学部の学生時代から石川春律先生のご指導のもと体中のあらゆる組織を電顕で観察され、また急速凍結ディープエッチング法などその当時次々と開発されつつあった手法を用いて軸索輸送や筋収縮機構を研究されてきた気鋭の形態学者であられた。 その講義は非常にシンプルなスライドで始まった。2つの細胞が接しているスライドで、組織内で細胞が増殖するには、2つのシグナル、一つは、当時すでに盛んに研究が行われていた増殖因子とその受容体を介するシグナル、 もうひとつは、隣り合う細胞同士の接着を調節するシグナルだが、こちらに関してはその重要性にまだまだ皆気づいていないと話された。そのスライドに続き、実際の組織内で細胞が接している部分はどのように見えるのかというのを、 代表的な小腸に始まり、肝臓や腎臓、やや特殊な心筋なども例に挙げ、非常に美しい電子顕微鏡写真で次々に解説された。そして、これら組織の構築・制御にとって本質的に重要だと考えられる、細胞間の接着を調節する分子機構を理解するのに、 電子顕微鏡にて観察される細胞間接着装置そのものを肝臓から生化学的に単離し、それを抗原としてモノクローナル抗体を作成、その中で接着装置を認識する抗体を選び、そのcDNAをクローニングすることで理解していくという、 今では誰もが知っているその研究戦略を、非常に力強く語られた。今から13、4年も前の話である。この講義では、その方法論で当時単離されたばかりの、Radixin、 α-catenin、ZO-1(220kd蛋白質と呼ばれていた)の話をされ、ZO-1に関しては、 心筋のintercalated discを例に挙げ、免疫電顕のデータから形質膜からほとんどゼロの距離のところに局在しており、膜蛋白質などに直接結合して細胞膜を裏打ちしているに違いないという話をされた。電子顕微鏡を通して実際に目で見た構造が、 どのような分子群により構成されているのかということが、こんなにもはっきり手に取るようにわかり表現できるものなのかと、言葉には言い表せない興奮とともに話を聞き終えたのを昨日のことのように思い出す。 その月田先生が昨年末若くして膵臓がんで亡くなられたのは本当に悲しい出来事であった。
このような経緯のもと、形態学的分子生物学を学ぶため月田研に進学した私は、大学院生としての研究を進めるとともに、それでは自分は将来どのような生物学的研究を進めていくのかを考え始めた。 具体的には形態学的に美しく生物学的に重要で、かつあまり研究がなされていない構造を探してみることにした。そこで最初に興味を惹かれたのが‘生殖質’と呼ばれる、ミトコンドリアや繊維性成分及びRNA蛋白質複合体に富む、多くの生物種の受精卵中に存在する構造であった。 発生生物学の研究から、発生最初期の細胞分裂に際し‘生殖質’を受け継いだ胚細胞のみが将来の生殖細胞に分化することが知られていた。 生殖細胞は多細胞生物に存在する細胞群中唯一その遺伝情報を後の世代に伝達する細胞系譜で、そうした生物種の永続性を保証する細胞の運命が発生最初期に現れる具体的な構造により規定される、というのは非常に面白い事実のように思えた。 この独特な構造を構成する因子は何であろうか、その単離と試験管内での再構成は可能であろうか、この構造がゲノムにどのような影響を与えるため生殖細胞のゲノムのみが次の世代を構成できるのか。 ところが勉強を進めるうちに、哺乳類の受精卵中には生殖質は認められず、哺乳類の生殖細胞は全く異なる機構により形成され、生殖質に形態学的に類似した構造はより後期の生殖細胞に認められるようになることを知った。 生殖質そのものの構成因子の研究がショウジョウバエや線虫の遺伝学により発展するであろうと予想されたことと、哺乳類での生殖細胞形成機構が当時ほとんど何もわかっていなかったことから、形態学的分子生物学とは少々始め方は異なってしまうが、私は哺乳類の生殖細胞に関して、それが最初期に形成される分子機構を出発点とした研究を進める決意をした。 そして、哺乳類生殖系列内でのゲノムインプリンティングを発見されたイギリス・ケンブリッジのAzim Surani教授の研究室で、月田研での教えに基づき、まずマウス生殖細胞が最初期から形態学的に選別可能であることを確認し、単一細胞発現遺伝子プロファイリングにより生殖細胞系列決定の分子モデルを提唱することに成功した[1]。 現所属の理化学研究所にてBlimp1が生殖細胞の決定に必須であること、Blimp1を用いたリポーターマウスにより生殖細胞形成過程の可視化に成功し[2]、最近では単一細胞マイクロアレイ技術を確立し[3]、生殖細胞内で起こる遺伝子発現動態の変化を正確に捉える基盤が出来た。決定直後の生殖細胞は、そのエピゲノムを大きく書き換えることもわかりつつあり[4]、生殖細胞形成過程は遺伝学的にプログラムされたエピゲノム修飾変換過程であると考えるに至っている。
こうして考えてくると単一細胞レベルの分解能で生命現象を明らかにしたいと考えてしまう癖は(哺乳類の生殖細胞に関してはそれが考えられる最も良い解析方法ではあったのだが)、やはり電子顕微鏡により様々な組織、細胞をそれなりに観察してきた知らず知らずの結果なのだろうと思われる。電子顕微鏡で見た細胞群というのは本当に一つとして同じものはないのではないかと思えるくらいに多様かつ複雑で、 その内部やその間で行われている多数の分子群の強調作業を想像すると本当にワクワクしてくる。こうした感想は、これまでに蓄積された膨大な電子顕微鏡写真を勉強することと、何らかの生体内の組織を実際に電子顕微鏡で見てみれば自然と湧いてくるものであり、電子顕微鏡観察の魅力は多くの生物種でそのゲノム配列が解読された今さらに大きくなるのではないかと感じている。 その上で、こんなことが将来出来れば面白いなと思うことを記すとすれば、電子顕微鏡レベル(の解像度)での細胞内現象のlive imagingかなあと思うのであるが、現在のところ固定や資料を真空中に置くことが必須な電子顕微鏡観察において果たして原理的に可能なのであろうか??
図の説明
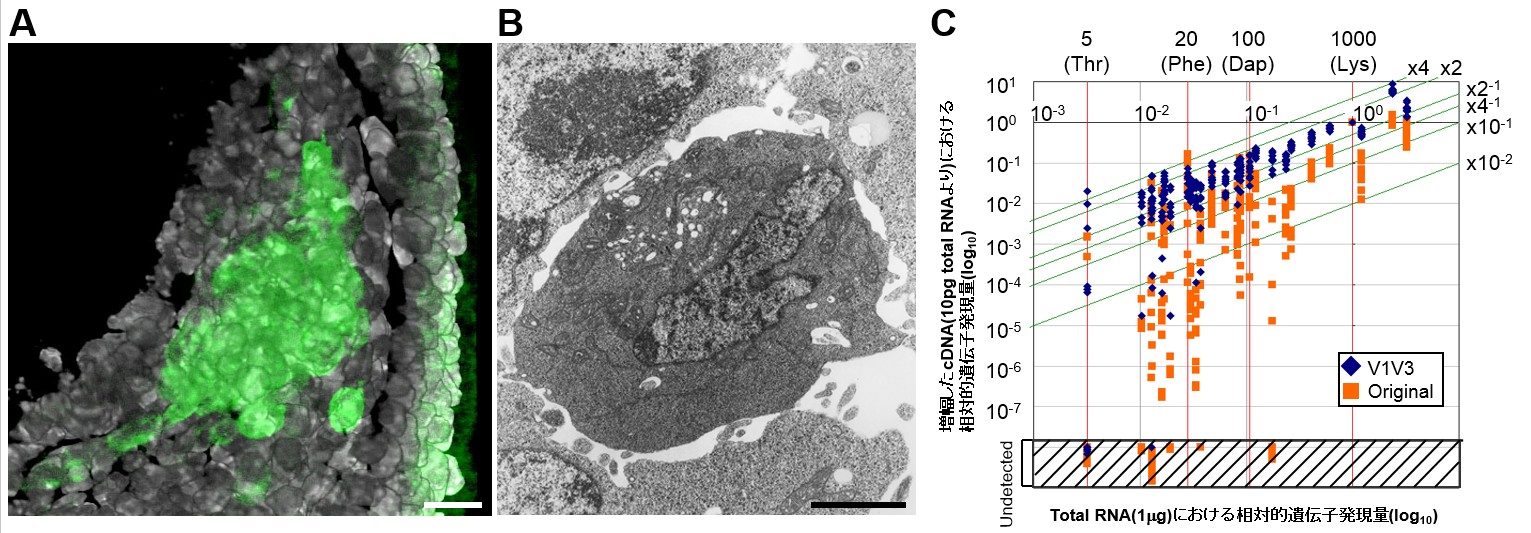
A. マウス発生7日目に出現する始原生殖細胞のクラスターをBlimp1-mEGFPトランスジーンにより可視化したもの。GFPは細胞膜に標的されている。共焦点顕微鏡による3D再構成像。Blimp1はこの時期始原生殖細胞(中央のクラスター)と臓側内胚葉(右側の上皮細胞層)に発現する。核をDAPI(白)にて染色。スケールバー, 20μm.
B. 発生7日目の始原生殖細胞の電子顕微鏡像。周囲の体細胞と比較し電子密度の高い細胞質を有する。スケールバー, 2μm.
C. 単一細胞cDNA増幅法。リアルタイムPCRを用いた我々の手法(V1V3) と従来法[5] (Original)の比較。単一細胞レベルに希釈したES細胞由来のtotal RNAを増幅し、増幅されたcDNAにおける相対的遺伝子発現量を、希釈前のサンプルに対してプロット。ES細胞での発現が知られる23個の遺伝子と、spike RNA (Lys [1000分子/細胞], Dap [100分子/細胞], Phe [20分子/細胞], Thr [5分子/細胞])を用いた (発現の高い順にEzh2, Gapdh, Oct4, Lys, Esg1, Sox2, Rex1, nanog, G9a, Dnmt3b, Dap, lefty1, fragilis, Dnmt1, Fgf4, Eras, Yy1, cMyc, nodal, Phe, Foxh1, Tiar, Jak1A, Tnap, stella, Tyk2, Thr)。遺伝子発現量はspike RNA Lysで正規化し、各spike RNAの発現量を赤い線で、希釈前試料に対する倍率変化2, 4,10, 100倍を緑色の線で示した。
文献
- Saitou M, Barton SC, Surani MA. A molecular programme for the specification of germ cell fate in mice. Nature 2002; 418: 293-300.
- Ohinata Y, Payer B, O'Carroll D, Ancelin K, Ono Y, Sano M, Barton SC, Obukhanych T, Nussenzweig M, Tarakhovsky A, Saitou M, Surani MA. Blimp1 is a critical determinant of the germ cell lineage in mice. Nature 2005; 436: 207-213.
- Kurimoto K, Yabuta Y, Ohinata Y, Ono Y, Uno KD, Yamada RG, Ueda HR, Saitou M. An improved single-cell cDNA amplification method for efficient high-density oligonucleotide microarray analysis. Nucleic Acids Res 2006; 34: e42.
- Seki Y, Hayashi K, Itoh K, Mizugaki M, Saitou M, Matsui Y. Extensive and orderly reprogramming of genome-wide chromatin modifications associated with specification and early development of germ cells in mice. Dev Biol 2005; 278: 440-458.
- Brady G, Barbara M, Iscove N. Representative in vitro cDNA amplification from individual hemopoietic cells and colonies. In: Methods Molec. Cell. Biol., vol. 2; 1990: 17-25.
1枚の写真館
出典:細胞工学 Vol.27, No.12, 1217, 2008
生まれたての生殖細胞cDNA!
ほ乳類の代表的モデル生物であるマウスにおいて、私が生殖細胞の起源と特性の研究を開始した当時(2000年当時)、発生初期に現れ、精子や卵子の源となる始原生殖細胞の形成機構は全く不明であった。そもそも始原生殖細胞を特異的に標識する分子マーカーすら無く、その運命を決定する遺伝子の同定は難しい仕事に思われた。始原生殖細胞は胚体外中胚葉中にアルカリフォスファターゼ活性陽性の3〜40個の細胞として出現することは古くから知られていた。私は、始原生殖細胞と近隣中胚葉細胞間の単一細胞cDNAライブラリーディファレンシャルスクリーニングこそ始原生殖細胞決定遺伝子群を同定する最良の方法と考え、マウス胚の始原生殖細胞出現予定領域を細かく切り出し単一細胞に解離後、ランダムに拾い上げた多くの単一細胞からcDNAライブラリーを作成した。しかしどのライブラリーが始原生殖細胞に由来するのか?様々な試行錯誤の末、絞られたライブラリーの中でHoxb1陰性のものこそ、始原生殖細胞由来に間違いないと確信するに至った。このライブラリーから、fragilis, stella1)が(fragilisはmil12)として松居靖久先生が、stellaはPgc73)として仲野徹先生がそれぞれ独自の方法で同時期に同定された)、さらに始原生殖細胞の転写制御に決定的な役割を果たすBlimp14), Prdm145)が単離された。単一細胞マイクロアレイ法の開発6)もここに始まった。
写真解説
始原生殖細胞出現予定領域を構成する細胞1個1個からcDNAライブラリーを作成し、その中のOct4陽性Tnap陽性Bmp4陰性ライブラリーにおけるHoxb1の発現を検討したアガロースゲル写真。Hoxb1陰性のライブラリーが始原生殖細胞に由来するもので、Hoxb1陽性のものは中胚葉細胞に由来する。
参考文献
- Saitou M, et al: Nature (2002) 418: 293-300
- Tanaka SS, et al: Mechanism of Development (2002) 119(Suppl.1): S261-S267
- Sato M, et al: Mechanism of Development (2002) 113: 91-94
- Ohinata Y, et al: Nature (2005) 436: 207-213
- Yamaji M, et al: Nature Genetics (2008) 40: 1016-1022
- Kurimoto K, et al: Nucleic Acids Research (2006) 34: e42